Jeder und Jede weiß es: alle Materie besteht aus Atomen!
Doch woher wissen wir, dass es Atome gibt? Es gibt sicher sehr viele Antworten zu dieser Frage; im Folgenden werden einige vorgestellt.
Das Gesetz der konstanten Proportionen
Bereits in der Antike wurde darüber spekuliert, dass es kleinste Teile der Materie gibt und sie nicht unendlich weiter teilbar ist. Der griechische Philosoph Demokrit war der erste, der den Begriff Atom verwandte. Es dauerte aber bis ins frühe 19. Jahrhundert, bis es erste ernst zu nehmende experimentelle Befunde für die Existenz der Atome gab.
Als Beispiel soll die Verbrennung der beiden Gase Sauerstoff (chem. Zeichen: O)und Wasserstoff (H) zu Wasser dienen. Es fiel auf, dass Sauerstoff und Wasserstoff immer im gleichen Mengenverhältnis umgesetzt werden: die umgesetzten Volumina H:O stehen im Verhältnis 2:1. Ist im Reaktionsgefäß genau doppelt soviel Wasserstoff wie Sauerstoff vorhanden, bleiben keine Rückstände der Gase übrig: die Umsetzung ist vollständig. Bei anderen Mengenverhältnissen der Ausgangsstoffe bleibt immer ein Rest eines der Gase übrig: Wasserstoff, wenn das Volumenverhältnis größer als 2:1 ist, Sauerstoff, wenn es kleiner ist.
Untersucht man, wieviel Gas übrig geblieben ist, stellt man fest, dass die reagierten Anteile genau das Verhältnis 2:1 bilden. Geht man davon aus, dass es für beide Gase eine kleinste Menge gibt, sind diese Befunde leicht zu erklären: die kleinste Menge Wasser besteht aus zwei Atomen Wasserstoff und einem Atom Sauerstoff.
Die Umsetzung von Wasserstoff und Sauerstoff ist nicht die einzige chemischen Reaktion, bei der sich die Ausgangsstoffe in einem festen Mengenverhältnis zum Produkt verbinden. Gleiches wird bei jeder chemischen Reaktion beobachtet.
Das Gesetz der multiplen Proportionen
Es gibt chemische Reaktionen, bei denen aus zwei Ausgangsstoffen mehrere Produkte enstehen können. Ein schon früh untersuchtes Beispiel ist die Umsetzung von Sauerstoff mit Stickstoff (N). Je nach Reaktionsbedingungenkönnen 5 verschiedene Produkte entstehen. Bei gleicher Stickstoff-Menge sind unterschiedliche Mengen Sauerstoff für die Bildung der Produkte notwendig.
Die 5 Sauerstoffmengen, die für die Produktbildung notwendig sind, stehen in einem kleinen ganzzahligen Verhältnis zueinander: 1:2:3:4:5 – unabhängig von der verwendeten Stickstoffmenge! Um es noch mal klar zu sagen: wenn ich 5g, 100g oder 1kg Stickstoff mit Sauerstoff umsetze, werden zwar höhere Sauerstoffmengen für die Produktbildung benötigt; immer stehen sie aber in dem geschilderten Verhältnis zueinander. Dies nennt man das Gesetz der multiplen Proportionen.
Wieder konnte dies am besten damit erklärt werden, dass sowohl Sauerstoff als auch Stickstoff aus kleinsten Einheiten bestehen: den Sauerstoff- bzw. Stickstoff-Atomen. Heute wissen wir, dass die Produkte die chemische Formel N2O, NO, N2O3, NO2 und N2O5 haben. Oder anders gesagt: auf 2 N-Atome komenn der Reihe nach 1, 2, 3, 4 und 5 O-Atome.
Es gibt zahlreiche weitere chemische Verbindungen, bei denen 2 Elemente in unterschiedlichen Verhältnissen miteinander reagieren. Und bei den allermeisten bestätigte sich das Gesetz der multiplen Proportionen…
Die Brown'sche Bewegung
Einen ganz anderen Zugang zur Atomhypothese beschritt Albert Einstein im Jahr 1905. Er nutzte die sog. Brown’sche Bewegung. Wenn kleine leichte Partikel – z.B. Pollen – in Wasser unter dem Mikroskop betrachtet werden, führen sie Zitterbewegungnen aus – selbst wenn Konvektionen (Strömungen) ausgeschlossen werden können. Sie diffundieren zufällig in der Flüssigkeit herum. Die Ursache war zunächst nicht völlig klar, obwohl schon früh spekuliert wurde, dass die Zitterbewegung durch zufällige Stöße von Wassermolekülen mit den Partikeln zustande kommt.
Einstein war in der Lage, ein mathematisches Modell zu entwickeln, das die Statistik der Zitterbewegungen aus den Stößen mit Wassermolekülen richtig berechnete. Zu dieser Zeit war aufgrund vieler anderer Befunde bereits stark vermutet worden, dass es Atome bzw. Moleküle gibt. Einsteins Ergebnisse waren aber der Tropfen, der die Atomhypothese entgültig in der Wissenschaft durchsetzte.
Im Beitrag zur Brown’schen Bewegung in Wikipedia kann man ein Video bewundern, in dem die Zitterbewegungen mit einem Mikroskop gefilmt wurden.
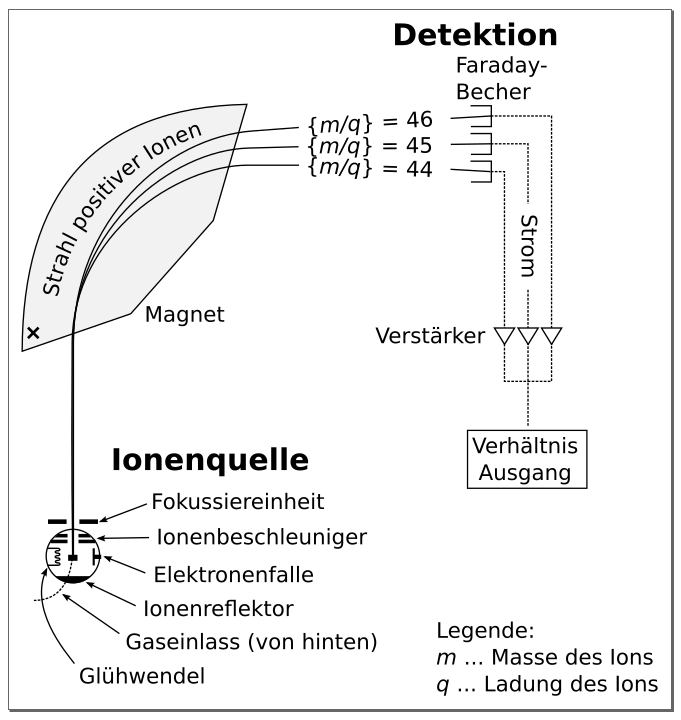
Massenspektrometrie
In der instrumentellen chemischen Analytik ist die Methode der Massenspektrometrie seit langem etabliert. Sie wird angewandt, um Substanzen zu identifizieren und die Struktur von – meist organischen – Molekülen aufzuklären.
In der klassischen Massenspektrometrie werden Substanzen im Vakuum verdampft und danach durch Elektronenstrahlen ionisiert. Die elektrisch geladenen Ionen werden durch ein elektrisches Feld beschleunigt und mit einem Massenanalysator nach ihren Massen getrennt. Man erhält ein Massenspektrum. In hoch auflösenden Massenspektrometern werden die beschleunigten Ionen durch ein starkes Magnetfeld geschickt. Dort wirkt die Lorenzkraft auf sie ein, so dass sie auf einer Kreisbahn fliegen. Deren Radius ist umso größer, je schwerer die Ionen sind. Man kann auf diese Weise die Masse der Ionen sehr genau messen.
Heutzutage gibt es noch eine Reihe anderer Ionisierungsmethoden, die aus der flüssigen oder gar festen Phase funktionieren. Man erhält Spektren, die nicht kontinuierlich sind, sondern einzelne Peaks bei bestimmten Ionenmassen. Im einfachsten Fällen – den Edelgasen – ist im Spektrum nur ein Massenpeak zu sehen. Dieser entspricht einem ionisierten Atom des Edelgases. Man misst also die Masse eines einzelnen Atoms!
Andere gasförmigen Elemente liegen meist als Molekül vor. Sauerstoff ist wie die meisten anderen gasförmigen Elemente ein Dimer (2 Sauerstoffatome sind aneinander gebunden). Hier gibt es einen Peak bei der doppelten Masse eines Sauerstoffatoms. Bei energiereichen Ionisierungsverfahren zerfallen manche Sauerstoffmoleküle in die einzelnen Atome bzw. Ionen. Auch diese erzeugen einen Massenpeak, so dass man die Atommasse bestimmen kann.
Auch viele kompliziertere Moleküle können so analysiert werden. Sie ergeben bei sanften Ionisierungsmethoden sog. Molekülpeaks; also Massenpeaks des intakten Moleküls. Darüber ist die direkte Bestimmung der Molekülmasse möglich.
All diese Befunde sind nur möglich, weil es kleinste Einheiten der analysierten Substanzen gibt. Sie sind deshalb eine starke Bestätigung der Atomhypothese.
Röntgen-Kristallstrukturanalyse
Durchstrahlt man Kristalle mit Röntgenstrahlen und fängt die Strahlung nach Passage des Kristalls auf einer Photoplatte oder – heute üblicher – mit Kameras auf, sieht man punktförmige Signale, die ein regelmäßiges Muster bilden.
Die Punkte kommen deshalb zustande, weil die Röntgenstrahlung an den Atomen, aus denen der Kristall besteht, gebeugt wird. Beugung kommt generell dann zustande, wenn die Wellenlänge der Strahlung ähnlich groß ist wie die Abstände der Streuzentren (hier: die Atome). Da der Atomabstand in Kristallen unter einem Nanometer liegen, muss die Wellenlänge der Strahlung in der gleichen Größenordnung liegen. Und das sind Röntgenstrahlen.
Gäbe es keine Atome, wäre die Materie also bis ins unendlich Kleine homogen, könnten keine Beugungsbilder entstehen. Ein weiterer Punkt auf der Indizienliste für die Atomhypothese.
Rastertunnelmikroskopie
Jetzt kommen wir zur gewissermaßen ultimativen Bestätigung der Atomhypothese: der Mikroskopie auf atomarem Niveau.
Ein sogenanntes Rastertunnelmikroskop ist in der Lage einzelne Atome aufzulösen. Dazu nutzt man extrem spitze Metallnadeln, die im Vakuum sehr nahe an die Oberfläche eines elektrisch leitenden Materials gebracht werden. Es wird eine elektrische Spannung zwischen Nadel und Oberfläche angelegt. Da Vakuum herrscht, kann eigentlich kein Strom zwischen Nadel und Oberfläche fließen.
Aufgrund eines quantenmechanischen Effekts, Tunneleffekt genannt, können bei sehr kleinen Abständen Elektronen trotzdem überspringen und einen (sehr kleinen) Tunnelstrom erzeugen. Um ein Bild zu erzeugen, wird die Nadel langsam über die Oberfläche bewegt. Der Abstand zwischen Nadelspitze und Oberfläche wird durch eine Regelung so verändert, dass der Tunnelstrom konstant bleibt. Der jeweilige Abstand ist dann das eigentliche Messsignal, das in einem Bild 2-dimensional aufgetragen wird.
Die Rastertunnel-Aufnahme zeigt die Oberfläche eines Graphit-Einkristalls in atomarer Auflösung, in der die regelmäßige Anordnung der Kohlenstoffatome sehr gut zu sehen ist.
Inzwischen ist es sogar möglich einzelne Atome aufzunehmen und an anderer Stelle wieder abzulegen und so Schriftzüge oder Logos auf atomarer Ebene zu erzeugen…