Wenn wir uns zuhause umschauen, sehen wir viele verschiedene Dinge: das Bücherregal, unser Smartphone, die Zimmerwand. Manchmal riechen wir auch etwas: das Parfum eines Freundes, den Knoblauchgeruch aus der Küche oder eine vergammelte Mandarine im Rucksack.
Unsere Welt ist extrem vielgestaltig: die Gegenstände und Lebewesen um uns herum können weich oder hart, grün oder blau, flüssig, fest oder gasförmig, durchsichtig oder undurchsichtig, schwer oder leicht sein. Schon die alten Griechen stellten sich die Frage, woher diese Vielfalt kommt und aus welchen Bestandteilen die materielle Welt besteht. Im folgenden Beitrag werden wir uns die materielle Welt wie mit einem Mikroskop vergrößert anschauen. Wir werden sehen, dass die Vielfalt aus sehr wenigen Grundbausteinen zusammen gesetzt ist.
Bei dieser Reise geht es nur um einen groben Einblick in die Struktur der Materie, um sich bei einem ersten Kontakt mit den diesbezüglichen Fragen nicht zu sehr in Einzelheiten zu verirren. In weiteren Beiträgen werden Einzelaspekte dann vertieft werden.
Reine Stoffe und Gemische
Stoffe wie Wasser oder Zahnpasta sehen einheitlich (homogen) aus, andere wie Granit oder Holz erscheinen uneinheitlich (heterogen) und bestehen offensichtlich aus unterschiedlichen Anteilen.
Bei homogenen Materialien unterscheidet man zwischen reinen und gemischten Stoffen, wobei der Augenschein oftmals keine Unterschiede feststsellen kann. Wasser ist beispielsweise ein reiner Stoff, Zahnpasta nicht (man schaue sich nur mal die Zusammensetzung in der Produktbeschreibung an).
Granit
Unterschiedliche Materialien werden durch dunkle und helle Bereiche angezeigt.
Holz
Die Maserung zeigt Bereiche unterschiedlicher Beschaffenheit an
Bei sehr starker Vergrößerung stellt man fest, dass reine Stoffe aus einheitlichen kleinsten Teilchen – den Molekülen – bestehen. Moleküle können weiter geteilt werden. Allerdings: Wenn Moleküle weiter geteilt werden, ändert sich der chemische Charakter des Stoffes. Denn ein Molekül besteht aus mehreren (meist verschiedenartigen) Atomen, die fest miteinander verbunden sind. Werden die Atome des Moleküls voneinander getrennt, entstehen Stoffe mit völlig anderen physikalischen und chemischen Eigenschaften.
Es gibt nur 92 unterschiedliche Atomsorten, aus denen alle natürlich vorkommende Materie (organischen oder anorganischen Ursprungs) besteht. Dies sind die sogenannten chemischen Elemente. Trotz ihrer geringen Zahl gibt es ungeheuer viele unterschiedliche Moleküle – und damit (reine) Stoffe. Denn Atome können auf vielfältige Weise miteinander verbunden sein. Und ein Molekül kann aus nur zwei Atomen bestehen (z.B. Stickstoffmonoxid, das in größeren Mengen giftig ist, in sehr niedrigen Mengen aber in unserem Körper zum Funktionieren unseres Kreislaufs unentbehrlich ist) oder aus Millionen Atomen (z.B. die DNA, die in jeder Zelle unseres Körpers vorkommt und unsere gesamte genetische Information enthält).
Was die Chemie angeht: bei den Atomen ist endgültig das Ende der Teilbarkeit erreicht. Allerdings können auch Atome in noch kleinere Bestandteile zerlegt werden: Elektronen bilden die Atomhülle, es gibt einen Atomkern, der seinerseits Protonen und Neutronen enthält, die ihrerseits aus sog. Quarks bestehen. Elektronen und Quarks sind nach heutigem Wissen echte Elementarteilchen, die wirklich nicht mehr teilbar sind.
Die chemischen Eigenschaften von Stoffen werden aber durch das Zusammenspiel von Elektronen und Atomkernen bestimmt. Insofern sind Atome und Moleküle die elementaren Bestandteile der Chemie. Im Folgenden schauen wir uns Atome etwas näher an.
Atome sind die kleinsten Einheiten der Chemie
Elektronen sind für das chemische Verhalten verantwortlich
Die Aussage, dass Atome die kleinsten Teilchen der Materie sind, stammt aus den Anfängen der Chemie als Wissenschaft. Aus den Ergebnissen diverser experimenteller Untersuchungen schloss man, dass Materie nicht unendlich weiter teilbar ist, sondern aus kleinsten Teilchen besteht, die man Atome (atomos: griechisch für unteilbar) nannte. Wer mehr über die Richtigkeit der Atomhypothese wissen will, kann sich unseren Beitrag Woher wissen wir, dass es Atome gibt? anschauen.
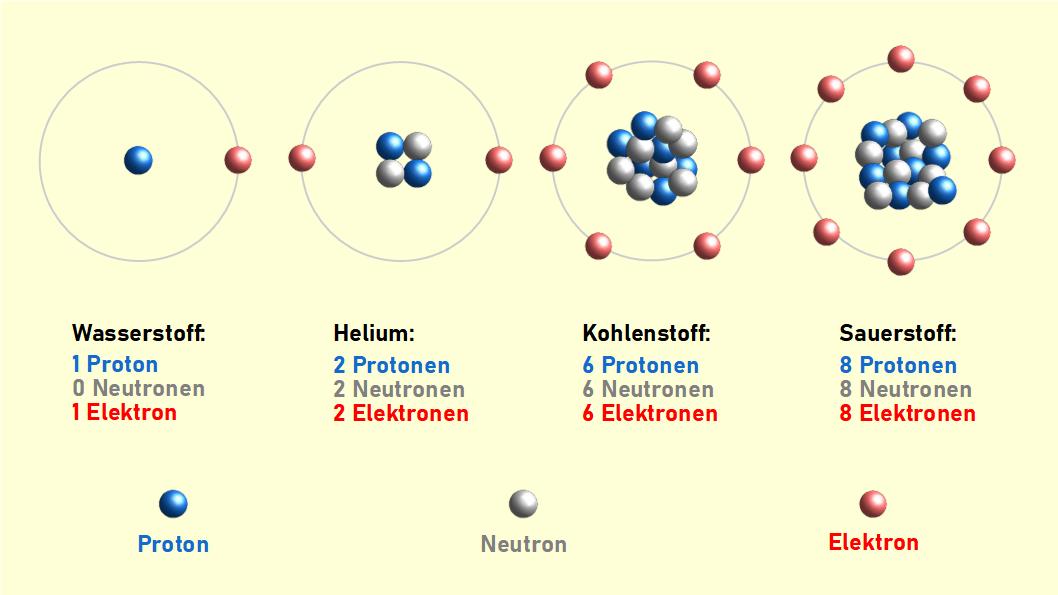
Heute wissen wir, dass Atome nicht unteilbar sind, sondern ihrerseits einen Kern und eine Hülle besitzen. Der Atomkern setzt sich aus Protonen und Neutronen zusammen, die Hülle wird von Elektronen gebildet. Ein Elektron ist ca. 2000 mal leichter als ein Proton bzw. Neutron. Protonen tragen eine positive, Elektronen eine negative elektrische Elementarladung; der Betrag ihrer Ladungen ist also gleich groß. Neutronen sind, wie der Name sagt, elektrisch neutral. Wichtig ist, dass die chemischen Eigenschaften der Atome so gut wie aussschließlich von der Wechselwirkung der Elektronen untereinander und mit dem Atomkern bestimmt werden. Insofern kann man sagen, dass Atome die kleinsten Einheiten der Chemie sind.
Auch Elektronen verschiedener Atome können miteinander wechselwirken, wenn sie sich nahe genug kommen. Auf diese Weise verbinden sich Atome zu Molekülen.
Wodurch unterscheiden sich die Atome der 92 Elemente?
Die Atome der chemischen Elemente unterscheiden sich in der Anzahl der Protonen im Kern bzw. der Elektronen in der Hülle. In jedem Atom gibt es gleich viele (positiv geladene) Protonen und (negativ geladene) Elektronen, so dass es insgesamt elektrisch neutral ist. Im Kern können noch unterschiedlich viele Neutronen vorhanden sein; diese haben aber kaum Einfluss auf die chemischen Eigenschaften. Neutronen sind nur wichtig für die Stabilität eines Atomkerns, da sie – anschaulich gesprochen – die sich abstoßenden positiven Ladungen der Protonen im Kern „verdünnen“. Zudem ziehen sich Neutronen und Protonen über die sog. Starke Kernkraft an. Neutronen helfen dadurch, die Protonen zusammen und den Kern stabil zu halten.
Das einfachste Element ist der Wasserstoff, dessen Atome nur ein Proton und ein Elektron enthalten. Das nächst schwerere Element ist das Helium mit zwei Protonen bzw. Elektronen. Am oberen Ende der natürlichen Elementliste steht das Uran mit 92 Protonen/Elektronen.
Atome verbinden sich zu Molekülen
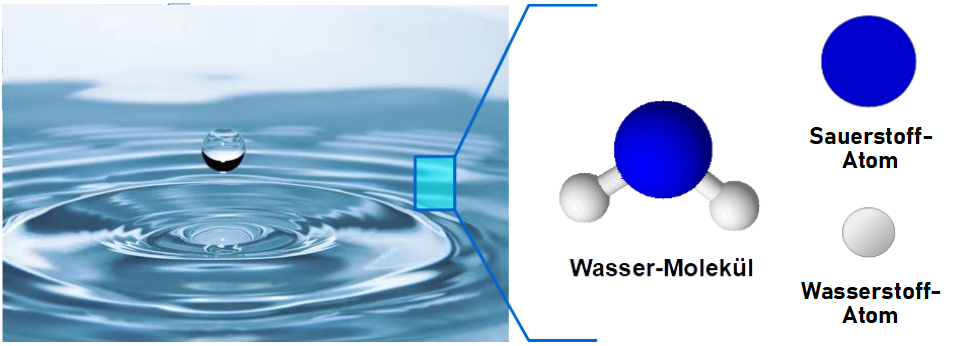
Es klang schon an: Atome können sich zu Molekülen verbinden. Eines der einfachsten Moleküle ist das von Wasser: zwei Wasserstoffatome sind mit einem Sauerstoffatom fest verbunden.
Doch es geht auch komplizierter!
Hämoglobin ist das Molekül, das in unserem Blut den Sauerstofftransport übernimmt. Es ist ein komplexes Protein – ein Eiweißstoff – mit einem Kanal in dem Sauerstoff für den Transport gebunden wird.
Nebenbei: Blut ist eines der komplexesten Substanzgemische, dessen Zusammensetzung bis heute nicht vollständig entschlüsselt wurde.
Chemische Struktur eines Hämoglobin-Moleküls
Wenn sich Atome zu Molekülen verbinden, ändern sich die Eigenschaften der entsprechenden Stoffe oft dramatisch. Wasser ist hier ein gutes Beispiel: Wasserstoff (chemisches Formelzeichen: H) und Sauerstoff (O) sind bei Raumtemperatur zwei Gase. Vermischt man die beiden Gase und hält eine Flamme an das Gemisch, verbinden sich jeweils zwei H- mit einem O-Atom explosionsartig zu Wassermolekülen (H2O). Wasser ist bei Raumtemperatur eine Flüssigkeit. Auch viele andere physikalische Eigenschaften und die chemische Reaktivität sind völlig unterschiedlich.
Zusammenfassung
- Alle existierenden Stoffe organischen oder anorganischen Ursprungs sind aus kleinsten Einheiten zusammen gesetzt.
- Die kleinsten Einheiten fast aller Substanzen sind Moleküle, die ihrerseits aus mehreren, fest miteinander verbundenen, Atomen bestehen.
- Atome haben einen Kern aus elektrisch positiven Protonen und ungeladenen Neutronen und eine Hülle aus elektrisch negativen Elektronen. Protonen und Elektronen tragen jeweils eine elektrische Elementarladung (±1,6⋅10-19 Coulomb).
- Die Anzahl der Protonen und Elektronen im Atom ist gleich; das Atom ist elektrisch neutral.
- Nur die 92 natürlich vorkommenden chemischen Elemente bestehen aus Atomen einer einzigen Sorte.
- Die Anzahl der Protonen im Atomkern bestimmt, welches chemische Element vorliegt.
- Die Moleküle chemisch reiner Stoffe sind alle gleich.
- Mischungen chemisch reiner Stoffe enthalten mehrere Molekülsorten.